SENYAWA YANG DIBAHAS
4. ALKIL HALIDA ( HALOALKANA )
SOAL SOAL SENYAWA KARBON GUGUS FUNGSI
SENYAWA KARBON
Adalah
senyawa rantai panjang berikatan secara kovalen mengandung unsur C, N, O, H.
Senyawa ini adalah termasuk dalam turunan Alkana , sehingga dalam penamaannya
mengikuti secara Alkana
Indikator
Pencapaian Kompetensi Dasar
1. Menganalisis struktrur senyawa
karbon
2. Menentukan tatanama senyawa
karbon
3. Menuliskan nama senyawa karbon menurut
aturan IUPAC
4. Menganalisis sifat fisik dan
kimia senyawa karbon
5. Menjelaskan proses pembuatan senyawa
karbon
6. Mendeskripsikan kegunaan senyawa
karbon
Materi Pembelajaran
Senyawa karbon adalah senyawa yang terdiri dari karbon, hidrogen, nitrogen, oksigen , dan unsur – unsur organik yang lain. Senyawa karbon dapat dikelompokkan berdasarkan gugus fungsi yang dimilikinya. Gugus fungsi adalah gugus atom yang menentukan struktur dan sifat senyawa karbon. Berikut ini beberapa gugus fungsi dari senyawa karbon.
Tabel 1 Gugus fungsi senyawa karbon
1. Alkohol dan Eter
a. Struktur alkohol dan eter
Alkohol dan eter merupakan isomer fungsi,
karena rumus molekulnya
sama tetapi rumus struktur
berbeda. Perhatikan perbedaan struktur alkohol dan eter berikut.
Tabel 1.1 Perbedaan struktur alkohol dan eter
b. Tatanama alkohol dan eter
Tatanama alkohol (alkanol)
Pemberian nama alkohol terdiri
atas dua sistem yaitu IUPAC (International Union of Pure and Applied
Chemistry) dan Trivial atau nama lazim (nama perdagangan)
a)
Tata
Nama IUPAC
Pemberian nama
alkohol seperti pada alkana , hanya akhiran -a diganti dengan akhiran -ol
(alkana menjadi alkanol)
Contoh :
CH3–CH2–OH etanol
Aturan penamaan
alkohol berikut !
1) Menentukan rantai utama , yaitu rantai
karbon terpanjang yang dilalui gugus – OH, atom karbon yang bukan rantai
utama sebagai cabang/ alkil
2) Memberi nomor pada rantai utama dari
karbon ujung yang terdekat gugus – OH sehingga memiliki nomor
terkecil.
3) Urutan penamaan: nomor cabang - nama cabang
- nomor atom C yang mengikat gugus - OH (kecuali untuk C nomor 1) - nama
rantai utama yaitu alkanol
4) Jika terdapat lebih dari satu gugus
-OH pada molekul yang sama (polihidroksil alkohol), digunakan akhiran
-diol, -triol, dan seterusnya.
Contoh:
b)
Tata Nama Trivial
Pemberian nama
secara trivial, yaitu nama gugus alkil yang terikat pada gugus –OH diikuti
kata alkohol.
Contoh:
CH3 – CH2– CH2 – OH propil alkohol
c. Jenis-jenis Alkohol
Berdasarkan
letak gugus –OH, alkohol dibedakan menjadi 3 macam, yaitu:
1) Alkohol Primer
Alkohol primer adalah alkohol yang gugus -OH terikat pada atom C primer
Contoh:
CH3 – CH2 – CH2 –
OH propanol
2) Alkohol sekunder adalah alkohol
yang gugus –OH terikat pada atom C sekunder.
Contoh:
3) Alkohol tersier adalah alkohol dengan
gugus –OH terikat pada atom C tersier.
Contoh:
Tata nama Eter (Alkoksi Alkana)
Seperti pada alkohol pemberian nama eter juga
ada dua sistem yaitu IUPAC dan Trivial atau nama lazim (nama
perdagangan)
a) Tata nama IUPAC.
Aturan penamaan sebagai berikut :
1)
Jika
R yang berbeda, maka nama Alkoksi adalah R yang lebih
pendek dan alkana adalah rantai R
yang lebih panjang.
2)
Penomoran
digunakan untuk letak gugus alkoksi dan letak
cabang alkil pada rantai alkana. Penomoran dari atom C yang
dekat gugus alkoksi –OR.
Contoh:
b) Nama trivial
Pemberian nama senyawa alkil alkil eter
diikuti kata alkohol. Nama senyawanya adalah alkil alkil eter. (alkil
diurutkan sesuai abjad)
Contoh
CH3 – CH2 – CH2 –O – CH3 metil propil eter.
d. Sifat akohol dan eter
1) Sifat alkohol
a) Sifat fisik
(1) Titik didih lebih relatif tinggi dari eter. Hal
ini disebabkan antara molekul alkohol terjadi ikatan hidrogen. Titik
didih semakin meningkat sesuai humlah atom C
(2) Kelarutan alkohol dalam air semakin
panjang rantai karbon semakin rendah kelarutannya. Metanol, etanol,
dan propanol mudah larut, alkohol lainnya hanya sedikit larut.
(3) Alkohol suku rendah (jumlah atom karbon 1- 4)
berupa cairan tidak berwarna, rantai sedang berupa zat cair kental,
rantai panjang jumlah atom 12 berupa zat padat yang tidak
bewarna
b) Sifat kimia
(1) Dapat Dioksidasi
Ø Oksidasi alkohol primer menghasilkan dua
jenis tahap awal menghasilkan aldehid selanjutnya menghasikan asam karboksilat.
Contoh:
Ø Oksidasi alkohol sekunder hanya satu menghasilkan
senyawa yaitu keton
Contoh:
Ø Oksidasi alkohol tersier tidak
teroksidasi
(2) Dapat bereaksi dengan logam (Na, K,
Mg, Al) melepas H2.
Contoh:
(3) Dengan asam
karboksilat membentuk ester (reaksi esterifikasi).
Secara umum:
Contoh:
(3) Dapat bereaksi dengan PX3,
PX5, , atau SOX membentuk alkil
halida. (R – X)
Contoh:
CH3–CH2 – OH + PCl3 → CH3 –
CH2 – Cl + H2O
etanol
etil
klorida
(4) Dengan asam halida (HX) membentuk alkil halida
Contoh:
CH3 – CH2 – OH +
HCl → CH3 – CH2 – Cl + H2O
etanol
etil klorida
(5) Dapat mengalami dehidrasi dengan H2SO4 pekat.
a. Pada suhu 140° C menghasilkan eter
b. Pada suhu 180°C menghasilkan alkena
2) Sifat eter
a. Sifat fisik
(1) Berupa zat cair (kecuali metil eter)
berbau harum dan mudah
menguap,
mudah terbakar, beracun
(2) Titik didih eter lebih rendah
daripada titik didih alcohol dengan
jumlah
atom C yang sama, karena eter tidak membentuk ikatan hidrogen
(3)
Kelarutan Meskipun
eter tidak dapat membentuk ikatan hidrogen,
(4) tetapi dapat bercampur dengan air,
karena eter dapat membentuk ikatan hidrogen dengan air. Oleh karena itu
eter sedikit larut dalam air. Kelarutan eter dalam air jauh
lebih kecil daripada kelarutan alkohol, sehingga umumnya eter tidak
bercampur dengan air.
b. Sifat kimia
(1) Tidak bereaksi dengan logam Na
dan PCl3, untuk membedakan
alkohol
dengan eter.
(2) Bereaksi dengan PCl5,
tetapi tidak membebaskan HCl (untuk
membedakan
alkoholdengan eter).
R – O – R' + PCl5 → R – Cl + R'Cl + POCl3
(3) Bereaksi dengan HX (X = F, Cl, Br, I).
R – O – R + HX → R – OH + RX
(4) Dengan
HI berlebih dan pemanasan menghasilkan R – I dan H2O.
(5) Eter
mudah terbakar membentuk gas CO2 dan uap air.
CH3 – O – CH3 + O2 → 2CO2 +
3H2
e. Pembuatan alkohol dan eter
1. Pembuatan Alkohol
a) Reduksi aldehid dan keton
b) Hidrolisis alkil hidrogen sulfat
c) Hidrasi alkena.
d) Hidrolisis ester.
e) Pembuatan alkohol menggunakan reagent
Grignard.
2. Pembuatan Eter
a) Dengan eliminasi alkohol pada suhu 140°C.
b) Eter dibuat dengan sintesis eter Williamson,
yaitu reaksi antara
alkil halida dengan suatu alkoksida.
R – X + R – ONa → R – O – R +
NaX
f. Kegunaan alkohol dan eter
1. Alkohol
a)
Metanol
Sebagai pelarut dan bahan bakar
b)
Etanol
Sebagai pelarut organik, parfum, cat, pernis, dan antiseptik (pencuci mulut mengandung alkohol 5% – 30%)
c)
Glikol
Untuk
zat anti beku pada radiator mobil (daerah bermusim dingin), bahan baku
dalam industri serat sintesis dan pelarut.
d)
Gliserol
Untuk
pelarut obat-obatan, bahan pembuatan gliserol trinitrat (bahan peledak)
2. Eter
a)
Eter Sebagai
pelarut senyawa organik, obat bius pada operasi, dan desinfektan (tetapi
sekarang tidak digunakan lagi sebagai obat bius).
b) MTBE (metil tersier butil eter) ditambahkan ke dalam bensin untuk meningkatkan bilangan oktan.
4. ALKIL HALIDA ( HALOALKANA )




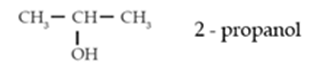













0 Comments
TERIMA KASIH