KONSEP
MOL
Di dalam mempelajari ilmu kimia
perlu diketahui suatu kuantitas yang berkaitan dengan jumlah atom, molekul,
ion, atau elektron dalam suatu cuplikan zat hal ini disebabkan dalam ilmu kimia
selain kuantitas maka kualitas suatu materi akan mempengaruhi hitungan kimia .
Menurut satuan Sistem Internasional (SI), satuan dasar dari kuantitas ini
disebut mol, sesuai yang disepakati dalam sidang IUPAC.
Satu mol menyatakan jumlah zat suatu sistem
yang mengandung sejumlah besaran elementer (atom, molekul, dan ion) yang setara
dengan banyaknya atom yang terdapat dalam 12 gram tepat isotop Karbon-12
(C-12). Jumlah besaran elementer tersebut disebut sebagai tetapan Avogadro dan
dilambangkan dengan R. Besarnya tetapan Avogadro ditentukan secara eksperimen,
dan harga tetapan Avogadro sebesar partikel.
Perkembangan penentuan massa
suatu atom haruslah mengunakan standart yang digunakan untuk acuan.
1.
Menggunakan 1 gram
massa hidrogen – 1 ( H-1 ) tetapi gas hidrogen adalah gas yang mudah meledak,
sehingga tidak digunakkan lagi
2.
Menggunakan 16 gram
massa oksigen – 16 ( O – 16 ), tetapi perkembangannya gas oksigen adalah gas
yang mudah bereaksi, sehingga sangat sulit digunakan sebagai standart.
Alasan kedua unsur tersebut digunakan sebagai
standart karena unsur tersebut banyak terdapat dialam.
3.
Menggunakan 12
gram massa karbon – 12 ( C – 12 ) dan ini
digunakan sebagai standart yang paling baik sampai sekarang.
Contoh :
massa rata rata unsur X adalah A gram dan massa rata
rata 1 atom karbon C – 12 adalah B gram maka Ar atom X adalah .....
Hubungan kelimpahan suatu atom dengan massa
atom relatif
Suatu atom dialam meliliki lebih dari 1 dengan
massa yang beragam, Setiap isotop memiliki
persentase kelimpahan tersendiri. Kelimpahan ini menunjukkan banyaknya suatu
isotop atom, di antara jumlah atom keseluruhan. Isotop Cl-37 dengan kelimpahan
25% artinya di alam terdapat 25 isotop Cl-37 dalam setiap 100 atom Cl.
maka untuk penentuan massa atom pun berbeda dengan rumus diatas.
Contoh
1.
Unsur
seng terdiri dari 60% isotop Zn-65 dan 40% isotop Zn-66.
2.
kelimpahan isotop dari
unsur boron masing-masing adalah 19% B-10 dan 81% B-11.
Dengan menjumlahkan hasil kali antara
persentase dan massa setiap isotop diperoleh massa rata-rata atom. Massa
rata-rata ini disebut massa atom relatif dan diberi simbol Ar.
Secara matematis dapat ditulis seperti berikut.
1. Unsur seng terdiri dari 60% isotop Zn-65 dan 40% isotop Zn-66. Tentukan massa rata-rata atom seng!
Jawab:
Ar Zn
= (%Zn−65 ⋅ mZn−65)+(%Zn−66 ⋅ mZn−66)
=
(60/100 ⋅ 65)+( 40/100 ⋅ 66)
=
(0,6 x 65) + ( 0,4 x 66 )
= 39+26.4 = 65.4
Jadi, massa rata-rata atom seng adalah
65,4
Rumus ini berlaku untuk atom dengan dua buah
isotop. Untuk atom yang jumlah isotopnya lebih dari dua, rumus di atas sisa
ditambahkan sehingga jumlah sukunya sama dengan jumlah isotop yang ada.
Rumus
yang sama juga digunakan untuk mencari persentase kelimpahan isotop. Kelimpahan
salah satu isotop dimisalkan dengan x%, dan kelimpahan isotop lainnya dengan
(100 - x)%.
Hukum Dasar Kimia
Hukum Dasar Kimia memuat hukum –
hukum dasar kimia yang meliputi
1.
hukum kekekalan massa,
2.
hukum perbandingan tetap,
3.
hukum perbandingan berganda,
4.
hukum perbandingan volume,
5.
hukum perbandingan volume gas (hipotesis avogadro).
1. Hukum Kekekalan Massa ~ Lavoisier
Tokoh yang mengenalkan hukum kekekalan
massa adalah Antonie Laurent Lavoisier.
Bunyi hukum kekekalan massa menyatakan
bahwa :
massa zat sebelum
reaksi adalah sama dengan massa zat hasil reaksi.
Tentu saja kondisi ini akan terlihat
pada sistem tertutup. Pada sistem terbuka, perubahan reaksi akan lebih susah
untuk diamati dengan baik.
Untuk lebih jelasnya perhatikan table pengamatan dibawah ini reaksi antara
besi dan sulfur yang menghasilkan besi (II) sulfide
Massa Zat yang bereaksi ( gr)
|
Massa Zat hasil Reaksi Besi (II)
Sulfida (gr)
|
|
Massa Besi
|
Massa Sulfur
|
|
14
|
8
|
22
|
28
|
16
|
44
|
42
|
24
|
66
|
56
|
32
|
88
|
2. Hukum Perbandingan Tetap ~ Proust
Hukum dasar kimia berikutnya adalah
hukum perbandingan tetap oleh Joseph Louis Proust.
Melalui pengamatan dari percobaan yang dilakukannya kemudian disimpulkan bunyi
hukum
perbandingan tetap yang menyatakan bahwa
perbandingan massa unsur – unsur penyusun dalam satu senyawa adalah tertentu
dan tetap.
Contohnya
pada perbandingan tetap pada pembentukan
senyawa air (H2O ) dari unsur hidrogen (H) dan
oksigen. Diketahui pembentukan senyawa H2O dari unsur
hidrogen dan oksigen dengan perbandingan 1 : 8.
Artinya setiap 1 satuan hidrogen yang
bereaksi dengan 8 satuan oksigen akan membentuk terbentuk senyawa 9 satuan H2O.
Bagaimanakah dengan proses pembentukkan senyawa? Apakah perbandingan zat –
zat yang beraksi juga tetap?perhatikan data pembentukkan senyawa air dari gas
hidrogen dan oksigen pada table berikut.
Massa unsur – unsur pembentuk (gram)
|
Massa senyawa air (gram)
|
Massa sisa
( gram )
|
|
Massa Hidrogen
|
Massa Oksigen
|
||
1,0
|
8,0
|
9
|
Habis
|
1,5
|
12
|
13,5
|
Habis
|
3,0
|
16
|
18,0
|
1 gram Hidrogen
|
2,5
|
20
|
22,5
|
Habis
|
3,0
|
26
|
27,0
|
2 gram oksigen
|
Baca lebih lanjut penerapan hukum dasar
kimia – hukum perbandingan tetap.
3. Hukum dalton
jika dua unsure membentuk dua macam senyawa
atau lebih, untuk massa salah satu unsure yang sama banyaknya, maka massa
unsure ke dua dalam senyawa – senyawa itu akan berbanding sebagai bilangan
bulat sederhana.
Menurut teori atom Dalton
senyawa terbentuk dari gabungan atom – atom dalam perbandingan sederhana.
Misalkan unsur X dan Y membentuk dua jenis senyawa XY dan X2Y3.
Jika massa unsur X dibuat sama ( berarti
jumlah atomnya sama) maka rumus senyawa XY dapat ditulis sebagai X2Y2.
XY ——> X2Y2
X2Y2 tetap
sebagai X2Y3
Berarti perbandingan
unsur Y dalam senyawa I dan II adalah 2 : 3
Untuk lebih jelas bisa
perhatikan contoh soal dibawah ini.
Contoh 1 :
Karbon dapat
bergabung denganhidrogen dengan perbandingan
3 : 1 membentuk gas metana berapa massa hidrogen yang diperlukan untuk bereaksi
dengan 900 gram C pada metana ?
Solusi :
C : H = 3 : 1
Maka massa H = 1/3
x 900 gram
= 300
gram.
Contoh 2 :
Unsur A dan unsur B
membentuk 2 senyawa yaitu X dan Y. Massa unsur A dalam senyawa X dan Y berturut
– turut adalah 46,7 % dan 30,4 %.
Tunjukkanlah bahwa hukum Dalton berlaku pada kedua senyawa tersebut ?
Solusi :
Solusi :
Senyawa
|
% A
|
% B = 100 – % A
|
X
|
46,7 %
|
100 – 46,7 % = 53,3 %
|
Y
|
30,4 %
|
100 – 30,4 % = 69,6 %
|
Agar persentase A sama
maka senyawa X dikalikan factor 2,14 dan senyawa Y dikalikan factor 3,28
sehingga diperoleh perbandingan massa X dan Y sebagai berikut :
Senyawa
|
Massa X (gr)
|
Massa Y (gr)
|
X
|
46,7 x 2,14 = 100
|
53,3 x 2,14 = 114,06
|
Y
|
30,4 x 3,28 = 100
|
69,6 x 3,28 = 228,28
|
Jadi dapat diketahui
perbandingannya X : Y = 114,06 : 228,28
= 1 : 2
Berdasarkan tiga hukum
diatas yaitu hukum kekelan massa, hukum perbandingan tetap, hukum kelipatan
perbandingan maka pada tahun 1803 Jhon Dalton mengemukakan suatu teori yang
kita kenal dengan teori atom Dalton. Antara lain postulatnya sebagai berikut :
Materi terdiri dari
partikel yang sudah tidak terbagi, yaitu atom
Atom – atom dari
unsure yang sama adalah identik tetapi berbeda dengan atom unsure lain.
Reaksi kimia adalah
penggabungan, pemisahan atau penataan ulang dari atom – atom dalam jumlah
sederhana. ukum Perbandingan Berganda ~ Dalton
4.
Hukum Perbandingan Volume ~ Gay Lussac
Selanjutnya adalah hukum dasar kimia
keempat yaitu hukum perbandingan volume Gay Lussac. Bunyi hukum perbandingan volume (Hukum Gay Lussac)
adalah
volume gas – gas yang bereaksi dan gas –
gas hasil reaksi, bila diukur pada suhu dan tekanan yang sama berbanding
sebagai bilangan yang bulat dan sederhana.
Baca lebih lanjut penjelasan hukum perbandingan volume Gay Lussac
5. Hukum Perbandingan Volume Gas ~ Avogadro
Hukum Gay Lussac di atas, kemudian
dikembangkan lagi menjadi hukum perbandingan gas Avogadro. Hukum perbandingan
volume gas Avogadro inilah yang menjadi hukum dasar kimia kelima. Avogadro
menyatakan bunyi hukum Avogadro
bahwa pada temperatur dan tekanan yang
sama, volume yang sama dari semua gas mengandung jumlah molekul yang sama.
SOAL LATIHAN
1.
Jika massa rata rata atom Boron 10.8 sma dan massa 1 atom C-12
adalah 12 sma maka massa atom relatif atom Boron adalah......
2.
Massa rata – rata atom A adalah 4X dan massa 1 atom C-12 adalah
3Y maka massa atom relatif A adalah.....
3.
Tentukan jumlah atom C, H, O dalam senyawa C2H5OH
4.
Tentukan Mr suatu senyawa dengan rumus molekul
a.
C6H12O6
b.
Al2(SO4)3
5.
Tuliskan bunyi hukum kekekalan massa dan hukum perbandingan
tetap
6.
Isilah ..... dalam ruang yang kosong dalam tabel berikut
Hasil
percobaan suatu reaksi pembentukkan senyawa FeS yaitu
diperoleh data
|
No
|
Massa Fe
( gram )
|
Massa O2
( gram )
|
Massa Fe2O3 yang terbentuk
( gram )
|
Sisa zat
|
|
1
|
|
|
40
|
0
|
|
2
|
14
|
|
|
2 gram O2
|
|
3
|
10
|
3
|
|
|
|
4
|
25
|
10
|
|
1 gram O2 dan 4 gram Fe
|
|
5
|
28
|
14
|
|
|
|
6
|
|
24
|
|
0
|
Dari data
juga dapat di simpulkan perbandingan massa Besi dan Oksigen dalam senyawa Fe2O3
adalah........
KONSEP MOL 2
Konsep mol dapat digunakan untuk menghitung rumus empiris suatu senyawa.
Rumus empiris adalah
rumus yang menyatakan perbandingan paling sederhana mol unsur-unsur pembentuk
senyawa.
Rumus empiris suatu senyawa dapat ditentukan melalui data komposisi persentase tiap unsur yang
menyusun senyawa tersebut. Komposisi
persentase merupakan persentase berdasarkan bobot (massa) setiap
unsur dalam senyawa tersebut.
Penentuan komposisi
persentase unsur merupakan salah satu dari analisis pertama yang dilakukan oleh
para kimiawan saat mempelajari senyawa baru. Sebagai contoh, suatu senyawa
mempunyai persentase massa unsur sebagai berikut : 26,4% Na, 36,8% S, dan 36,8%
O. Kita dapat mengasumsikan massa senyawa sebesar 100 gram (basis persentase adalah per 100), sehingga
persentase tersebut dapat digunakan sebagai massa unsur. Dengan demikian, mol
masing-masing unsur dapat ditentukan.
mol Na = 26,4 gram /
22,99 gram.mol-1 = 1,15 mol Na
mol S = 36,8 gram /
32,07 gram.mol-1 = 1,15 mol S
mol O = 36,8 gram /
16,00 gram.mol-1 = 2,30 mol O
Rumus empiris senyawa
tersebut adalah Na1,15S1,15O2,30.
Maka untuk mendapat rumus kimia
secara empirisnya harus mengikuti hukum dasar dari Proust perbandingannya harus
bulat dan sederhana, maka hasil dari mol masing masing atom dibagi dengan nilai
yang paling kecil
Na = 1,15/1,15 = 1
S = 1,15/1,15
= 1
O = 2,30/1,15 = 2
memiliki Rumus empiris NaSO2.
Massa molekul relatif (Mr)
untuk Rumus empiris tersebut
adalah 22,99 + 32,07 + 2(16,00) = 87,06 gram/mol.
Pada percobaan lain,
telah diketahui berdasarkan analisis spektromassa, bahwa senyawa tersebut
memiliki bobot (massa) molekul sebesar 174,12 gram/mol.
Rumus molekul (Rm) suatu
senyawa merupakan kelipatan dari Rumus empiris ( Re ) senyawa bersangkutan. Dengan membagi 174,12
Rumus
molekul (Rm) = (Mr Re)n =
( Mr Rumus molekul )
= ( 87,06 )n = 147,12
= n = 147,12 / 87,06
= n =2
Rumus molekul
(formula) senyawa tersebut
sesungguhnya adalah (NaSO2)2 = Na2S2O4.
Hubungan antara mol dengan satuan atau
besaran besaran kimia lainnya
Keterangan satuan
P = tekanan ( atm )
V = volume ( liter )
n = mol
R = tetapan gas ( 0,082 atm.L. K-1.mol-1 )
Partikel dapat berupa atom, molekul, ion dan elektron
Ar dapat di lihat dalam SPU atau diketahui dalam soal
A adalah Ar
Mr adalah jumlah Ar dalam senyawa atau molekul
H2O = ( 2x Ar H + 1x Ar O )
= ( 2.(1) + 1.(16) ) = 18
Molaritas ( M )
Adalah besarnya mol dalam 1000mL atau 1 Liter larutan
PERSAMAAN REAKSI
Persamaan reaksi atau persamaan kimia adalah penulisan
simbolis dari sebuah reaksi kimia. Rumus kimia pereaksi ditulis di sebelah kiri
persamaan dan rumus kimia produk dituliskan di sebelah kanan. Angka yang
ditulis di sebelah kiri rumus kimia sebuah zat adalah koefisien stoikiometri,
sedangkan huruf kecil yang ditulis dibawah zat disebut dengan fase zat
Fase zat ada 4 jenis
1. Cairan
/ liquit ( l )
2. Larutan
/ aqua ( aq )
3. Gase
/ gas ( g )
4. Padatan
/ solid ( s )
Secara
umum persamaan reaksi ditulis sebagai berikut
Persamaan adalah gambaran banyak zat yang terlibat dalam
suatu reaksi berupat massa, jumlah molekul dan volume zat.
Penyetaraan reaksi kimia dapat dilakukan dengan dua
cara yaitu
1. Cara
al jabar
2. Cara
langsung
Syarat dalam menyetarakan persamaan reaksi adalah
-
Rumus kimia tertulis dengan benar
-
Hanya boleh ditambahkan angka dalam bentuk
koefesien saja sedang indeks tidak boleh dirubah
-
Persamaan dinyatakan benar bila jumlah
atom dikiri dengan dikanan tanda panah jumlahnya sama tanpa merubah indek
Cara al jabar
a.
Tetapkan
koefisien CH4 = 1, Sedangkan yang lainnya dengan huruf.
b. Penyetaraan atom C dan H dan O
di ruas
kiri di ruas kanan
C 1 = b
H 4 = 2c
O 2a = 2b + c
Langkah selanjutnya mencari nilai a, b,
dan c
b =
1
2c
= 4........... c = 4/2
= 2
2a = 2b + c
2a
= 2(1) + 2 ............ 2a = 2 + 2
............ a = 4/2 = 2
cara langsung yaitu
Perhatikan jenis atom
di kiri dan dikanan hanya satu dimiliki oleh satu zat saja dan jumlah disamakan
lalu sesuaikan....
LATIHAN MENYELESAIKAN PERSAMAAN REAKSI
- Na2CO3(aq) +
H2SO4(aq) → Na2SO4(aq) +
CO2(g) + H2O(g)
- Pb(CH3COO)2(aq) +
2KI(aq) → PbI2(s) + 2CH3COOK(aq)
- (NH4)2SO4(aq) +
2NaOH(aq) → Na2SO4(aq) + 2NH3(g) +
2H2O(g)
- Fe(s) +
2HCl(s) → FeCl2(s) + H2(g)
- Fe2O3(s) +
3H2SO4(aq) → Fe2(SO4)3(aq) +
3H2O(aq)
- CO2(g) +
2KOH(aq) → K2CO3(aq) + H2O(aq)
- 2Al(s) +
3H2SO4(aq) → Al2(SO4)3(aq) +
3H2(g)
- P2O5(s) +
6KOH(aq) → 2K3PO4(aq) + 3H2O(aq)
- 2KClO3(s) +
3S(s) → 2KCl(s) + 3SO2(g)
- CuSO4(aq) +
2NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq)
- C(s) +
O2(g) → 2CO(g)
- 2C2H2(g) +
5O2(g) → 4CO2(g) + 2H2O(g)
- 4Al(s) +
3O2(g) → 2Al2O3(s)
- Ca(s) +
2H2O(l) → Ca(OH)2(s) + H2(g)
- 2C8H18(l) +
25O2(g) → 16CO2(g) + 18H2O(g)
- 2CO(g) +
O2(g) → 2CO2(g)
- CH4(g) +
H2O(g) → CO(g) + 3H2(g)
- 2Al(s) +
3Cl2(g) → 2AlCl3(s)
- CaO(s) +
2NH4Cl(l) → 2NH3(g) + H2O(g) +
CaCl2(g)
- CuSO4(aq) +
4NH3(aq) → Cu(NH3)4SO4(aq)








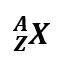





0 Comments
TERIMA KASIH