Konsep Mol
Mol adalah satuan hitung dalam bidang kimia yang digunakan untuk dapat memudahkan perhitungan.
Mol
dapat didefinisikan sebagai perbandingan antara nilai massa sesungguhnya suatu
senyawa dibandingkan dengan massa atom atau molekul relatif senyawa tersebut.
Menurut penelitian yang dilakukan oleh Avogadro, jumlah partikel yang ada di dalam 12 gram atom C-12 adalah sebanyak 6,02 x 1023 buah partikel. Bilangan ini kemudian dikenal secara luas sebagai bilangan Avogadro dengan notasi NA atau L yang menyatakan bahwa di dalam 1 mol zat tertentu mengandung sebanyak 6,02 x 1023 buah partikel zat itu sendiri.
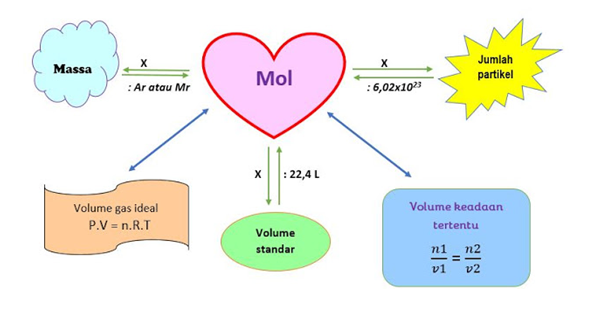
1. Hubungan mol dengan Ar atau Mr
Contoh.
1) Jumlah
Mol dari 8 gram gas oksigen ( O2 ) dik Ar. O= 16
2) 49
gram asam sulfat H2SO4 memiliki mol…….( Ar. H=1, S=32,
O=16 )
2. Hubungan mol dengan jumlah partikel ( tetapan Avogadro = 6,02 x 1023 )
Partikel dapat berupa : atom, iom, molekul
Contoh.
1) Jumlah
mol dari 3,01 x 1023 atom
emas (Au) adalah….
2) Sebanyak
=
6,02
x 1022 molekul air H2O ,
mempunyai nilai mol …..
3. Hubungan mol volume molar
Volume
molar adalah volume gas yang diukur pada suhu 0oC dan tekanan 1
atsmofir (STP) yang memiliki besar 1 mol gas (0oC dan 1 atsmofir) =
22,4 L
contoh
1) Berapakah mol yang dimiliki oleh gas
Nirogen 5,6 liter diukur pada (0oC dan 1 atsmofir) adalah…..
2) Berapakah
volume gas hydrogen yang mempunyai 0,6 mol diukur pada STP
Volume STP H2 =
mol x volume molar
=
0,6 mol x 22,4 Liter
=
13,44 Liter
4. Hubungan mol dengan volume gas ideal
Volume
gas idela yaitu volume yg diukur pada kondisi yg dibuat dengan rumus
P.V = n. R. T
P = tekanan (atm)
V = volume ( L )
n = mol
R = tetapan gas ideal (0,082 L.atm/mol.K)
K = suhu mutlak dalam Kelvin (K) ( K =
oC + 273 )
Contoh,
1)
Hitunglah mol dari gas karbon dioksida ( CO2 ) yang
mempunyai volume 49,2 L bila diukur pada tekanan 1 atm dan suhu 27 oC……
P.V = n. R. T
2) Hitunglah volumr 14 gram gas nitrogen (N2)yang
diukur pada suhu 127 oC dan tekanan 2 atm ( Ar. N =14 )
5. Hubungan mol dengan volume gas pada
keadaan tertentu (P,T)
Volume
gas pada keadaan tertentu adalah kondisi dimana volume gas A akan sama dengan
volume gas B bila kondisi ruang memiliki tekanan dan suhu yang sama. Secara matematis
dirumuskan sebagai berikut :
nA
= mol zat A
VA
= volume zat A
nB
= mol zat B
VB
= volume zat B
Contoh
1) Hitunglah mol gas oksigen yang
bervolume 12 L diukur pada kondisi dimana 0,5 mol gas hydrogen bervolume 4 L
2) 11 gram gas kabon dioksida (CO2)
bervolume 8 liter sedangkan molekul Z yang massanya 23 gram bervolume 16 liter, maka besarnya Mr zat Z
adalah ……. ( Ar. C = 12, O = 16 )
Secara diagram dapat di gambarkan…..
Contoh
soal keseluruhan
1. Diketahui 3,2 gram belerang dioksida
tentukanlah….
a. Mol belerang dioksida
b. Jumlah molekul belerang dioksida
c. Volume gas belerang dioksida diukur
pada ( 0oc,1 atm )
d. Volume gas belerang dioksida diukur
pada ( 27oc,1 atm)
e. Volume gas belerang dioksida diukur
pada 8 gram gas oksigen bervolume 12 Liter
(
Ar. S = 32, O = 16 )
Jawab.
LATIHAN :
1. Hitung berapakah mol molekul yang terdapat dalam 6 gram
glukosa (C6H12O6), diketahui Ar C = 12, O =
16, serta H = 1.
2. Berapa gram massa Urea (CO(H2)2) yang mengandung 0,15 mol
urea?
Ar C = 12, O = 16, N = 14, H=1
3. Konversikan 5.3 x 1025 molekul karbon dioksida ke dalam
jumlah mol
4. Jika 2,4 x 1023 atom unsur X massa nya adalah 60
gram,maka massa atom relatif X adalah ( L =6 x 1023)
5. Volume 7,5 gram gas NO pada suhu 0°C dan tekanan 1 atmosfer
adalah….(Ar N=14;O=16)
6. Jika pada STP volume dari 4,25 gram gas sebesar 2,8 liter,
maka massa molekul relatif gas tersebut (Mr) adalah…
7. Diketahui massa NaOH adalah 80 gram . tentukan berapa
volume senyawa tersebut dalam keadaan STP !
8. 5 mol gas N2 berada pada suhu 27°C pada tekanan 1,5 atm.
Volume gas N2 tersebut adalah....
9. Pada suhu 25⁰C dan tekanan 2 atm volume 42 g gas nitrogen
adalah . .
10. Suatu tabung gas diisi dengan 5 mol O2 dengan volume 10
L. Tabung tersebut dikosongkan lalu diganti dengan 15 mol N2. Tentukan volume
gas N2 pada tabung tersebut.
11. . Pada suhu dan tekanan tertentu 1,0 L gas NO (Mr=30)
massanya 1,5 g volume gas oksigen, pada suhu dan tekanan yang sama,yang
dihasilkan jika 49 g KClO₃ (Mr=122,5) dipanaskan adalah








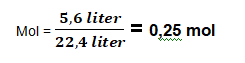







0 Comments
TERIMA KASIH